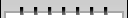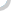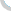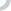| 无GMP证书药厂须停产 不会造成供应不足(组图) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| http://www.sina.com.cn 2004年06月28日15:58 新华网 | |||||||||
|
新华网北京6月28日电(记者张晓松)“7月1日还没有拿到GMP(药品生产质量管理规范)证书的药厂必须停产。”国家食品药品监督管理局安全监管司有关负责人日前在接受新华社记者专访时指出,在规定期限内严格实施GMP认证,不仅有利于促进我国药品生产企业提高生产管理水平,淘汰那些生产技术装备及管理落后的企业,控制低水平重复建设,也是我国药品生产企业与国际质量标准体系接轨并逐步走向世界的需要。图:北京一家已通过GMP认证的中成药生产企业制剂车间。新华社记者 张晓松摄GMP制剂生产车间内工作情
7月1日后约40%药品生产企业面临停产 这位负责人指出,根据《中华人民共和国药品管理法》,药品生产企业必须按照药品监管部门制定的GMP组织生产。国家食品药品监督管理局据此制定了分剂型、分步骤、限期强制实施GMP的规划,要求所有药品制剂和原料药生产企业(或车间)在今年6月30日前必须通过GMP认证,否则一律停止生产。 “从目前掌握的情况看,6月30日前能够通过认证的企业约在3100家左右,占全国的61%。到7月1日,将有近2000家企业和近900家车间被迫停产,依法监督这些企业和车间停止生产药品的任务相当艰巨。”这位负责人表示,“即使如此,认证时限不会延期,认证标准不会降低。” 据介绍,国家食品药品监督管理局已发出通知,要求各省级食品药品监管部门,按照法定程序,监督应停产的药品生产企业停止生产相应药品,应停产的每个企业都要有现场检查人员,责任到人;凡是应停产而不停产的药品生产企业,要按照有关规定进行查处。国家食品药品监督管理局将对各省、区、市的GMP认证工作进行监督和抽查,如果发现有违规降低标准的现象将坚决依法处理,并追究有关单位及人员责任。 这位负责人说,6月30日前未通过认证的企业已经生产的合格药品,还可以在其有效期内合法流通,监管部门将对这些药品加强监督检查,进行质量追踪。 GMP证书是国内药厂进入国际市场的“通行证” 据介绍,长期以来,各地因为片面追求经济效益,竞相开办药厂。1985年以前我国只有1000家左右药厂,到1990年猛增到3700家,到1995年又增加到6300家,而其中相当一部分企业生产、检测设备落后,技术管理人员不足,质量保证体系不健全,品种质量和技术含量低。同时,低水平重复建设还引发了各种不正当竞争,导致竞相回扣,劣药泛滥。 “其实,在国外,开办药品生产企业的门槛是很高的。世界上多数国家和地区都强制实行GMP认证,世界卫生组织也明确要求所有出口药品必须符合GMP要求。” 这位负责人告诉记者,从1998年起,我国开始分剂型、分步骤、限期强制实施GMP。1998年,我国只有87家企业通过GMP认证;截至目前,血液制品、粉针剂、大容量注射剂和小容量注射剂生产企业已先后全部通过了认证;预计到年底,将有4000家药品制剂和原料药生产企业通过认证。 实施GMP认证,促进了医药经济结构调整,初步改变了我国药品生产企业多、小、散、乱的问题,1998年以来,我国药品生产企业数量不但没有继续大幅增长,反而有所减少,目前已经通过GMP认证的3000多家企业占据了近90%的市场份额,企业的社会效益和经济效益总体水平显著提高;药品质量也在不断提高,1998年药品市场抽验合格率为89%,到2003年已达到97.1%,连续4年保持在95%以上;国内药品生产企业还初步具备了参与国际竞争的资格,去年底世界卫生组织对我国疫苗生产企业实施GMP情况的考核结果显示,国产疫苗有望列入其国际采购名单。 大批企业停产不会造成国内药品市场供应不足 大批药品生产企业停产是否会影响药品市场的供应并导致药品价格的波动?应该不会。 据这位负责人介绍,目前,我国药品市场总体供大于求。通过GMP认证的药品生产企业虽然只占到全部药品生产企业的60%,但却占据了国内药品市场近90%的份额,生产的药品涵盖了所有临床常用品种,完全可以满足市场需求;而面临停产的企业大部分实际已经停产,正在生产的产量也很低,所生产的药品基本没有什么急症用药和独家品种。 根据规定,2000年12月31日前,国内所有大容量注射剂生产企业都必须通过GMP认证,2001年1月1日共有167家因此停产,超过相关企业总数的40%,但并未引起大的市场波动。因此,7月1日后,国内药品市场理应不会出现供应不足的情况,药品价格也不会有大的变化。 “当然,不怕一万就怕万一。为此,我们专门制订了应急预案。”这位负责人说,国家食品药品监督管理局已要求各省级食品药品监管部门,从7月1日开始到年底实行周报告制度,即在密切关注各地药品市场的供求变化、及时了解掌握可能出现的药品短缺情况的基础上,每周一将上周企业GMP认证、企业停产及检查情况、市场供应以及社会稳定等情况报告国家食品药品监督管理局,并重点对独家生产药品的供应予以保证。 | |||||||||
| 新浪首页 > 新闻中心 > 国内新闻 > 正文 |
|
| ||||||||||||||
|
|
新闻中心意见反馈留言板 电话:010-82612286 欢迎批评指正 新浪简介 | About Sina | 广告服务 | 招聘信息 | 网站律师 | SINA English | 产品答疑 Copyright © 1996 - 2004 SINA Inc. All Rights Reserved 版权所有 新浪网 |