我国两家甲型流感疫苗公司需近4千名受试志愿者
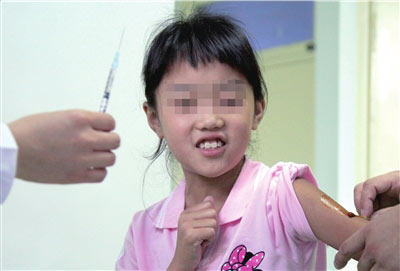
本报讯(记者叶洲) 昨天早上6时,北京科兴生物制品有限公司生产的甲型H1N1流感疫苗在完成生物、生化实验后,正式开始临床试验。当日,位于河南新乡的华兰生物也启动了甲流疫苗临床试验。两组试验共需近4000名受试志愿者参与。
临床试验是大规模生产之前的基础性准备工作。据北京科兴生物制品有限公司总经理尹卫东介绍,此次临床试验将对生产出来的疫苗进行严格论证,对疫苗的安全性、有效性以及接种的有关策略,比如间隔、剂量、禁忌症以及重点人群等等,做出科学的评估。
尹卫东说,科兴疫苗的临床试验由北京疾病预防控制中心负责实施,由疾控部门来选择临床受试志愿者。本次试验共需受试志愿者1600名,接种程序为60岁以上老年组接种1针;3岁至60岁的成人、少年和儿童组需要接种2针。预计,本周所有受试者完成第一针接种,8月中旬开始第二针接种,9月中旬完成全部临床研究。试验疫苗共分3种类型:加佐剂灭活疫苗(5微克、10微克)、加佐剂裂解疫苗(7.5微克、15微克)、无佐剂裂解疫苗(15微克、30微克)。
北京科兴于6月8日正式获得由美国CDC提供的甲型H1N1流感疫苗生产用毒株NYMC X-179A,当晚立即启动了种子批制备工作,6月15日正式开始第一批疫苗的生产。7月3日第一批疫苗正式送中国药品生物制品检定所检定,截至7月21日,共计有8批疫苗获得检定合格证书。
另据了解,昨天早上7时,华兰生物在江苏泰州也启动了临床试验。华兰生物将招募2000多名志愿者,分批于7月22日、7月24日和7月25日接种。他们的接种将分为五个年龄组进行。
中国应对甲型H1N1流感联防联控工作机制专家委员会疫苗专家指导组组长赵铠表示,根据我国目前制定的甲型H1N1流感防控策略,甲型H1N1流感疫苗研制成功后不会上市销售。生产出来的疫苗将用于国家储备,以应对今年秋冬季节可能出现的流感疫情。其是否使用以及如何使用将由国家统一调配,国家将根据疫情的发展及其危害程度,判断是否启用储备疫苗。
此外,记者从中国疾控中心获悉,甲流疫苗临床试验时,如果出现受试志愿者死亡或严重残疾、群体性不良反应、对社会有重大影响的不良反应等任意一种情况时,有关部门将会进行评估后再决定是否继续临床试验。
相关媒体报道:
新京报:我国首批甲型流感疫苗开始临床试验
> 相关专题:
更多关于 甲型流感 疫苗 的新闻
- 我国首批甲型流感疫苗开始临床试验 2009-07-23 02:05
- 加拿大报告首例抗药性甲型流感病例 2009-07-23 01:56
- 匈牙利出现首例甲型流感死亡病例 2009-07-23 00:33
- 中国内地2天新增甲型流感确诊病例104例 2009-07-22 23:49
- 美国等对暴发新一轮甲型流感表示担忧 2009-07-22 22:26
| 闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤缂嶅﹪寮婚悢鍏尖拻閻庨潧澹婂Σ顔剧磼閻愵剙鍔ょ紓宥咃躬瀵鎮㈤崗灏栨嫽闁诲酣娼ф竟濠偽i鍓х<闁诡垎鍐f寖闂佺娅曢幑鍥灳閺冨牆绀冩い蹇庣娴滈箖鏌ㄥ┑鍡欏嚬缂併劌銈搁弻鐔兼儌閸濄儳袦闂佸搫鐭夌紞渚€銆佸鈧幃娆撳箹椤撶噥妫ч梻鍌欑窔濞佳兾涘▎鎴炴殰闁圭儤顨愮紞鏍ㄧ節闂堟侗鍎愰柡鍛叀閺屾稑鈽夐崡鐐差潻濡炪們鍎查懝楣冨煘閹寸偛绠犻梺绋匡攻椤ㄥ棝骞堥妸鈺傚€婚柦妯侯槺閿涙盯姊虹紒妯哄闁稿簺鍊濆畷鎴犫偓锝庡枟閻撶喐淇婇婵嗗惞婵犫偓娴犲鐓冪憸婊堝礂濞戞碍顐芥慨姗嗗墻閸ゆ洟鏌熺紒銏犳灈妞ゎ偄鎳橀弻宥夊煛娴e憡娈查梺缁樼箖閻楃姴顫忕紒妯肩懝闁逞屽墴閸┾偓妞ゆ帒鍊告禒婊堟煠濞茶鐏¢柡鍛埣楠炲秹顢欓崜褝绱叉俊鐐€栧濠氬煕閸儲鍋傚┑鍌氭啞閻撴瑦銇勯弮鍥舵綈婵炲懎娲ㄧ槐鎺撴綇閵娿儳鐟ㄩ柧浼欑秮閺岋綁骞橀幎绛嬧偓妤冪磼閻橆喖鍔︽慨濠傤煼瀹曟帒鈻庨幒鎴濆腐缂傚倷绶¢崳顕€宕归崼鏇炍ラ柛鎰靛枛瀹告繈鎮楀☉娅亝绂嶆潏銊х瘈闁汇垽娼у瓭闁诲孩鍑归崣鍐€侀弴鐔侯浄閻庯綆鍋嗛崢鍓х磼閻愵剚绶茬€规洦鍓氶弲鍫曟偋閸粎绠氬銈嗗姦閸嬪嫰鎮橀敃鍌涚厸鐎光偓閳ь剟宕伴弽顓溾偓浣糕槈閵忕姴鑰垮┑掳鍊愰崑鎾淬亜韫囧﹥娅呴棁澶愭煟濡寧鐝悘蹇ラ檮閹便劍绻濋崘鈹夸虎閻庤娲﹂崑濠傜暦閻旂⒈鏁嗗ù锝囨嚀椤忔澘鈹戦悩鍨毄闁稿濮锋禍绋库枎閹惧磭鐛ラ柟鍏肩暘閸斿秹宕戦埡鍛厽闁硅揪绲借闂佺ǹ顑呴崐鍧楃嵁閺嶎偀鍋撳☉娆嶁偓鐐哄箣閿曗偓濡﹢鏌嶈閸撶喎顫忕紒妯诲閻熸瑥瀚禒鈺呮⒑缁嬪灝顒㈤柟绋垮暱閻e嘲煤椤忓嫬鍞ㄥ銈嗘尵閸犳劕鈻嶉弽銊х闁圭偓娼欓悞褰掓煕鐎n偅灏伴柟渚垮妽缁绘繈宕熼鐐殿偧闂備胶鎳撻崲鏌ュ箠濡櫣鏆﹂柕濠忓缁♀偓闂佺ǹ鏈粙鎺楁偩婵傚憡鈷掗柛灞剧懄缁佹壆鈧娲滈弫璇茬暦娴兼潙骞㈡繛鎴炨缚閿涚喖姊虹憴鍕姸婵☆偄瀚划濠氬蓟閵夛妇鍘棅顐㈡处濞叉牠顢撶仦鍓х缂佹鎼慨鍌炴煛鐏炵晫啸妞ぱ傜窔閺屾盯骞樼€靛憡鍣板銈冨灪瀹€鎼佸极閹版澘骞㈡繛鍡樺灩濡插洦绻濆▓鍨灍闁挎洍鏅犲畷鏇㈡偨缁嬭法鍘搁梺鍛婁緱閸犳岸宕㈤幘缁樷拺闁告稑锕︾粻鎾绘倵濮樼厧澧撮柛鈹惧亾濡炪倖宸婚崑鎾绘煙鐠囇呯?缂侇喖顑呴鍏煎緞鐎n亖鍋撻悜鑺ョ厽闁瑰鍊戝璺虹闁惧繐婀辩壕钘壝归敐鍛棌闁稿孩鍔欓幃妤冪箔濞戞ê鏋﹂柤鏉挎健閺岀喎鈻撻崹顔界亾缂佺偓鍎抽妶鎼佸箖濡ゅ懏鏅查幖绮光偓鑼泿闂備浇顕х换鎰版偤閵娾晛桅闁告洦鍨伴~鍛存煃閳轰礁鏋ゆ俊顐㈠暣濮婄儤娼幍顔煎闂佸湱鎳撳ú顓烆嚕椤愶箑绠荤紓浣股戝▍銏ゆ⒑鐠恒劌娅愰柟鍑ゆ嫹闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤濠€閬嶅焵椤掑倹鍤€閻庢凹鍙冨畷宕囧鐎c劋姹楅梺鍦劋閸ㄥ綊宕愰悙鐑樺仭婵犲﹤鍟扮粻鑽も偓娈垮枟婵炲﹪寮崘顔肩<婵炴垶鑹鹃獮鍫熶繆閻愵亜鈧倝宕㈡禒瀣瀭闁割煈鍋嗛々鍙夌節闂堟侗鍎愰柣鎾存礃缁绘盯宕卞Δ鍐唺缂備胶濮锋晶妤呭Φ閸曨垼鏁傞柛鏇ㄥ亝濞堝爼姊洪柅鐐茶嫰婢у墽绱撳鍛棡缂佸倸绉归幃娆撳传閸曨収妲遍柣鐔哥矌婢ф鏁Δ鍛亗闁绘柨鍚嬮悡娆撴煟閹寸伝顏堟偂閳ь剟姊绘繝搴″⒒闁告挾鍠栧濠氭晬閸曨亝鍕冮梺缁樺姦閸撴盯藝閵娧呯=濞达綀娅g敮娑㈡煟閳哄﹤鐏︽鐐插暙閳诲酣骞欓崘鈺傛珜濠电偠鎻徊浠嬪箹椤愩倕绶ら柣锝呯灱绾句粙鏌涚仦鎹愬闁逞屽墰閸忔﹢骞婂Δ鍛殝闂傚牊绋戦悘浣割渻閵堝棙灏柛銊ョ秺瀹曞綊宕掗悙瀵稿幈濡炪倖鍔х徊鍓х矆閳ь剟姊洪挊澶婃殶闁哥姵鐗犲濠氬即閻旇櫣顔曢梺缁樺姦閸撴岸鎮甸弴銏♀拺缂佸顑欓崕蹇斾繆椤愶絿绠炵€殿喛顕ч埥澶婎潩椤愶絽濯伴梻浣告啞閹稿棝鍩€椤掆偓鍗遍柛顐g箥濞撳鏌曢崼婵囧殗闁绘稒绮撻弻鐔煎礄閵堝棗顏�闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤缂嶅﹪寮婚悢鍏尖拻閻庨潧澹婂Σ顔剧磼閻愵剙鍔ゆ繝鈧柆宥呯劦妞ゆ帒鍊归崵鈧柣搴㈠嚬閸欏啫鐣峰畷鍥ь棜閻庯絻鍔嬪Ч妤呮⒑閸︻厼鍔嬮柛銊ョ秺瀹曟劙鎮欓悜妯轰画濠电姴锕ら崯鎵不閼姐倐鍋撳▓鍨灍濠电偛锕顐﹀礃椤旇偐锛滃┑鐐村灦閼归箖鐛崼鐔剁箚闁绘劦浜滈埀顑惧€濆畷銏$鐎n亜鐎梺鍓茬厛閸嬪棝銆呴崣澶岀瘈闂傚牊渚楅崕鎰版煟閹惧瓨绀冪紒缁樼洴瀹曞崬螖閸愵亶鍞虹紓鍌欒兌婵灚绻涙繝鍥ц摕鐎广儱鐗滃銊╂⒑閸涘﹥灏伴柣鐔濆懎鍨濋悹鍥ф▕閸氬顭跨捄鐚村姛闁挎稓鍠栧缁樼瑹閸パ冾潻闂佸憡顨嗗ú鐔风暦閸洦鏁嗗璺侯儐濞呮牗绻濋悽闈浶㈤柨鏇樺€濋獮濠囧箛閻楀牆鈧灝鈹戦崒姘暈闁抽攱鍨块弻娑樷槈濮楀牆浼愭繝娈垮枓閸嬫捇姊绘担鍛婃儓闁稿﹥鎮傚畷鎰板捶椤撶姷鐒块悗骞垮劚閹冲宕奸鍫熺厱闁哄洦顨嗗▍鍐磼閵娿儺鐓兼慨濠呮閹叉挳宕熼銈庢О婵犵數鍋涢ˇ浼存儎椤栨凹鍤曢柛娑橈攻閸庣喖鏌曟繝蹇擃洭闁告ü绮欏Λ鍛搭敃閵忊€冲亶闂佺ǹ瀛╂繛濠囩嵁閸愵喗鍤冮柍鍝勫暟閿涙粓鏌℃径濠勫闁告柨鐬肩划顓烆潩椤撶姷顔曢梺缁樻尭濞撮绮荤拠娴嬫斀闁斥晛鍟崐鎰版煛娴gǹ鏆i柛鈹惧亾濡炪倖甯掔€氼參藟婢跺备鍋撻獮鍨姎婵☆偅绋撶划缁樸偅閸愨晝鍙嗗┑鐘绘涧濡瑩宕冲ú顏呯厵闁稿繒鍘ф慨宥夋煛鐏炶濮傜€殿喗鎸虫俊鎼佸Χ婢跺﹣绮e┑掳鍊楁慨鐑藉磻濞戙垹鐤い鎰剁畱閻撴繈骞栧ǎ顒€濡肩紒鐘层偢閺屾盯骞囬妸锔界彆濠电偛鎳庡Λ婵嗩潖缂佹ɑ濯撮柛娑橈工閺嗗牆鈹戦悙鏉戠祷缂佺粯锚閻e嘲鈹戦崼婊勫媰闂佸憡鎸嗙仦楣冩暅婵犲痉鏉库偓褏寰婃禒瀣柈妞ゆ牜鍋為崑鍌涚箾閹寸偛鐒归柛瀣崌閻涱噣宕归鐓庮潛婵犵數鍋為幐鎶藉绩鏉堚晝鐭夐柟鐑樺灍閸亪鏌涢弴銊ュ箻妞ゆ梹娲熷娲偡閹殿喗鎲奸梺鑽ゅ枂閸庣敻骞冨鈧崺锟犲礃椤忓棴绱查梻浣虹帛閻熴儵骞婇幇顔剧煋妞ゆ洍鍋撻柡宀嬬磿娴狅妇鎷犻幓鎺濇綆闁诲孩顔栭崰妤€岣垮▎鎺斾簷闂備線鈧偛鑻晶顖滅磼閸屾氨效鐎规洘绮忛ˇ瀵哥棯閹规劖顥夐棁澶愭煥濠靛棙鍣洪柟顖氱墛閵囧嫭鎯旈敍鍕姱闂佸搫鏈惄顖涗繆閹间礁唯鐟滃秹鎮¢悢鍏煎€垫繛鍫濈仢閺嬫稒銇勯銏℃暠濞e洤锕獮鏍ㄦ媴閸濄儱骞愰梻浣呵归張顒勬儗椤旀崘濮冲ù鐘差儐閳锋帒霉閿濆懏鍤堢憸鐗堝笒鐎氬銇勯幒鎴濃偓濠氭儗濞嗘挻鐓欓弶鍫熷劤閻︽粓鏌℃担绋库偓鍧楀蓟閵娾晜鍋嗛柛灞剧☉椤忥拷 | 闂傚倸鍊搁崐鎼佸磹閹间礁纾归柟闂寸绾惧綊鏌熼梻瀵割槮缁炬儳缍婇弻鐔兼⒒鐎靛壊妲紒鐐劤缂嶅﹪寮婚悢鍏尖拻閻庨潧澹婂Σ顔剧磼閻愵剙鍔ゆ繝鈧柆宥呯劦妞ゆ帒鍊归崵鈧柣搴㈠嚬閸欏啫鐣峰畷鍥ь棜閻庯絻鍔嬪Ч妤呮⒑閸︻厼鍔嬮柛銊ョ秺瀹曟劙鎮欓悜妯轰画濠电姴锕ら崯鎵不閼姐倐鍋撳▓鍨灍濠电偛锕顐﹀礃椤旇偐锛滃┑鐐村灦閼归箖鐛Δ鍛拻濞撴埃鍋撴繛浣冲懏宕查柛鈩冪☉缁犵姵鎱ㄥΟ鎸庣【闁圭鍩栭妵鍕箻鐠哄搫澹夊┑鈽嗗亝缁秶鎹㈠┑瀣仺闂傚牊鍒€閿濆洨妫柡澶庢硶鏁堥梺璇″櫙缁绘繈骞冮姀銈呯闁兼祴鏅涢獮宥夋⒒閸屾瑧璐伴柛娆忕箳缁骞嬮敃鈧崙鐘绘煟閺傚灝鎮戦柣鎾寸洴閺屾盯鍨惧畷鍥╊唹濠电偛鎳庨敃顏堝蓟閳ュ磭鏆嗛悗锝庡墰琚︽俊鐐€戦崹娲晝閵忋倕绠栭柕蹇嬪€栭崐缁樹繆椤栨粌鍔嬮柣婵呭嵆濮婂宕掑▎鎴М闂佸湱鈷堥崑濠囧箚婢跺闄勭紒瀣硶閻涖儵姊虹憴鍕妞ゆ泦鍥ㄥ€块柛顭戝亖娴滄粓鏌熼悜妯虹仴闁逞屽墮缂嶅﹤顕i幎钘夌厸闁告侗鍘奸崵鎴濐渻閵堝懐绠板┑鐐诧龚閵囨劙骞掗幘鍏呮睏婵犵數鍋涘Λ妤冩崲閹寸偛绶為柛鏇ㄥ灡閻撳啴姊洪崹顕呭剰婵炴惌鍣i弻锛勪沪閸撗勫垱閻庢鍠楅幐铏繆閹间礁唯闁靛牆娲ㄥ▔鍨攽閿涘嫬浜奸柛濠冩礀闇夋慨妯挎硾閻鏌涢幇闈涙灈闁藉啰鍠栭弻宥夊Ψ閵壯嶇礊闂佸搫妫楀Λ婵嬪箖濡ゅ懏鏅查幖绮光偓鎰佹骄闂備椒绱粻鎴︽偋閹捐绠栨俊銈呭暞閸犲棝鏌涢弴銊ュ妞わ负鍔戝娲箰鎼淬垻锛橀梺鎼炲妿閸庛倗绮氭潏銊х瘈闁搞儜鍜佸晣濠电偠鎻紞鈧柛濠佺矙婵℃悂鍩¢崒婊冨妇闂傚⿴鍋勫ú锕€煤閺嵮呮瘓婵犵數濮伴崹濂革綖婢跺⊕娲偄婵傚缍庡┑鐐叉▕娴滄繈宕戦崒鐐茬闁圭⒈鍘奸弸鐔虹磽瀹ュ棭娈滄慨濠呮缁瑩宕犻埄鍐╂毎婵$偑鍊戦崝灞轿涘☉姘灊婵炲棙鍔曠欢鐐测攽閻樻煡顎楅柟顔藉灦缁绘繈濮€閿濆棛銆愬銈嗗灥濞差厼鐣烽姀銈呯濞达絽鍘滈幏娲⒑閸涘﹦鈽夐柨鏇樺€栭幈銊╁磼閻愬鍘遍梺鍝勫€搁悘婵嬵敆閵忋倖鐓涢柛娑氬绾箖鏌嶉挊澶樻█濠殿喒鍋撻梺鎸庣☉鐎氼剟鐛Δ鍛拻濞达絿鐡斿ḿ鎰偓瑙勬礃閿氶柍缁樻煥閳藉濮€閻樻彃娈ゆ繝鐢靛仦閸垶宕瑰ú顏呭亗婵炴垶鍩冮崑鎾诲礂婢跺﹣澹曢梺璇插嚱缂嶅棝宕滃☉銏″剨闁割偁鍎查崐鐢告偡濞嗗繐顏紒鈧崘顔藉仺妞ゆ牗绋戝ù顕€鏌涢埞鍨姕鐎垫澘瀚换婵囨償閵忕姷绱﹂梻鍌欒兌绾爼宕滃┑瀣ㄢ偓鍐幢濞戞瑥浠鹃梺绋跨灱閸嬬偤鍩涢幒妤佺厱閻忕偛澧介幊鍡涙煕韫囨挾鐒搁柡宀€鍠栭幖褰掝敃閿濆懐顣叉俊鐐€栧ú鈺冪礊娴e摜鏆﹀┑鍌溓归崡鎶芥煟閹邦喗鏆╅柡鍡╁亰濮婄粯鎷呴崨闈涚秺閹绺界粙璺紱濠电偞鍨崹铏光偓姘嚇閺岋綁寮崶銉㈠亾閳ь剟鏌涚€n偅宕岄柣娑卞櫍瀹曞綊顢欓悡搴經濠电姷鏁搁崑娑㈡儑娴兼潙绀夐幖娣灮閻濆爼鏌¢崶銉ョ仼缂佲偓閸岀偞鈷掗柛灞惧嚬閸ょ喓绱掗悩瀹犲妞ゎ亜鍟存俊鍫曞幢濞嗗浚娼风紓鍌欑椤戝棛鏁埄鍐х箚闁汇垹鎲¢崑鍕⒒閳ь剟骞囬鍓ф毎濠碉紕鍋戦崐鏍礉閹达箑鍨傜憸鐗堝笒濮规煡鏌ㄥ┑鍡橆棡闁告瑥绻愰埞鎴︽偐閹绘帗娈查梺闈涙处缁诲嫰鍩€椤掑喚娼愭繛璇х畵瀹曟垶绻濋崒婊勬闂佺粯姊婚埛鍫ュ极閸ヮ剚鐓熸俊顖氥仒閸氼偆绱掗埀顒勫礃椤旇В鎷婚梺绋挎湰閻熝囁囬敃鍌涚厵闁兼亽鍎抽惌瀣煙娓氬灝濮傞柟顔荤矙瀹曘劍绻濋崒娆戠秿闂傚倷鑳剁划顖氱幓鐠恒劌鍨濇い鏍仜绾剧粯淇婇娑氭菇濞存粍绮撻弻锟犲炊椤垶鐣舵繛瀛樼矒缁犳牠骞冨Δ鍐╁枂闁告洦鍓涢ˇ銉╂倵鐟欏嫭澶勯柛鎾跺枛閺佹劙鎮欏ù瀣杸闁诲函缍嗘禍鐐核囪缁绘繈濮€閿濆棛銆愰梺鍛娚戠划鎾愁嚕閺屻儲鍋愮€瑰壊鍠楃紞搴g磽閸屾瑧鍔嶉拑鍗炩攽椤栨稒灏﹂柡灞剧☉閳藉顫滈崼鐔告毎闂備胶枪鐎涒晠骞愰幖浣哥厴闁硅揪绠戦悡锟犳煕閳╁啨浠︾紒銊ㄥ亹缁辨挻鎷呯粵瀣闂佸摜鍠愭竟鍡涘礆閹烘柡鍋撻敐搴濇喚闁告艾顑夐弻娑㈠Ψ閿濆懎顬堢紒鍓ц檸閸ㄨ京鎹㈠☉銏犵闁哄鍨靛В鍫ユ⒑閹肩偛濮€濞存粠鍓涘Σ鎰版倷鐎涙ê鍔呴梺闈涚箞閸ㄥ鎯侀崼銉︹拺婵懓娲ら悘鍙夌箾娴e啿瀚晶锟犳⒒閸屾瑦绁板鐟扮墦閿濈偞寰勯幇顒傦紵闂佽鍎艰闁逞屽墯濡啫鐣峰鈧崺锟犲礃閻愵剛銈梻浣筋嚙閸戠晫绱為崱娑樼;闁糕剝绋戦崒銊╂⒑椤掆偓缁夌敻鍩涢幋鐘垫/妞ゆ挾鍋為崳褰掓煟閹哄秶鐭欓柡灞剧洴瀵剛鎹勯妸鎰╁灲閺屽秶鎷犻懠顑呪偓瑙勬磸閸旀垿銆佸▎鎰闁规鍠氬▔鍧楁⒒閸屾埃鐪嬮柛瀣鐓ら柕蹇嬪€曠壕鍧楁煠绾板崬鍘撮柛瀣尭椤繈鎮欓鈧锟� |
|




