来源:潇湘晨报
近日,赵立坚妻子分享抗癌经历引发热议。
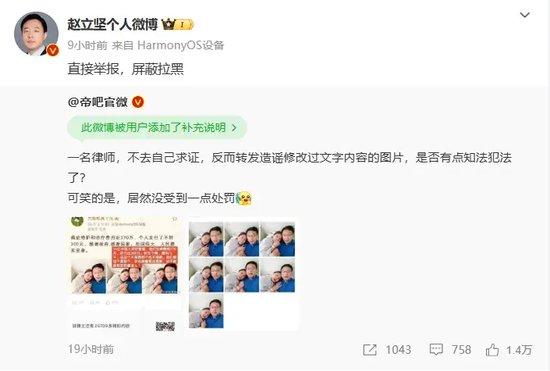
8月6日,配有赵立坚夫妇合照和原博极为相似的图片在网上流传,图中配文“癌症特护和治疗费近370万,个人支付不到300元”。
8月7日,赵立坚辟谣:“直接举报,屏蔽拉黑。”
目前,未经核实发布该图的账号已被禁言。
此前报道:赵立坚妻子分享抗癌经历,术后放弃化疗选择中医
转自:医学界
撰文 | 燕小六
外交部前发言人赵立坚的妻子汤天如,日前通过其个人微博@大聪和臭丫头 分享了她的抗癌经历。因其在手术后没有听从医生建议进行放化疗,转而选择去看中医,引起了很多医疗专业人士的关注。
据其讲述,去年6月她确诊恶性三阴性乳腺癌5期,在北京公立医院分两次完成手术,并做了淋巴清扫。术后医生为她安排同时进行8期化疗和放疗,并叮嘱一个月内开始化疗和放疗效果最好。
经过多方咨询专业医生后,医生告诉她如果不化疗和放疗生存期只有6个月。如果配合治疗,有50%的机会可以活6-24个月。最终汤天如决定不接受西医治疗,因为“我不想天天让他陪着我去医院,也不想看到自己只能虚弱地坐在轮椅上,既然时间那么短就不要再折腾自己,让自己最后的时间舒服些,选择中医调理。”
三阴性乳腺癌已不再“无药可治”
如今距汤女士确诊患癌已经过去了一年多,近日她在微博中称自己是“死里逃生”,不知道除了中医之外,她是否还进行过其他治疗。
对于汤女士的抗癌故事,知名健康博主庄时利和发微博表示很钦佩她把亲身经历分享出来的勇气,能够让更多女性了解到乳腺癌,“但是其中有一些建议是不准确的,可能会误导其他女性,因此有必要明确一下,比如她在手术后医生安排了放化疗,她决定不做这些治疗,进行中医调理。”
庄时利和指出,汤女士关于自己确诊“三阴性乳腺癌5期”可能是错误的表述,因为首先乳腺癌的分期为0期、I期、II期、III期和IV期,最晚期是IV期,意味着有远端转移,手术无法根治,通常不会作为主要治疗手段。而汤女士做了手术,并进行了淋巴结清扫,庄时利和据此猜测,她可能说的是BI-RADS分级里面的5类结节,这是乳腺癌筛查中的影像学表述,并不是临床分期。
庄时利和还指出,三阴性乳腺癌的预后虽然会比一般乳腺癌差一些,但是早期的5年生存率也有91%,局部晚期为65%。即便是IV期的三阴性乳腺癌,这几年也有许多新药上市,可以显著延长患者的生存期。因此他在微博中强调,肿瘤患者需要接受正规治疗。有研究显示,相比接受正规治疗的乳腺癌患者,接受替代治疗的患者5年死亡率高了5.7倍。
上海交通大学医学院附属新华医院乳腺外科学科带头人韩宝三告诉“医学界”,目前随着医学进步,三阴性乳腺癌已不再是“无药可治”,只是相较于其他类型的乳腺癌而言,治疗手段相对少一些。
三阴性乳腺癌有多“阴”?
2020年的一份文献显示,三阴性乳腺癌好发于40岁以下未绝经女性。《中国年轻乳腺癌诊疗专家共识(2022)》指出,这可能是因为年轻患者更易出现易感基因致病突变。而因为年龄和基因特征,年轻患者可能更易经历诊断延误、面临更晚的肿瘤分期。
它还存在侵袭性、复发率双高等特点。北京协和医院乳腺外科孙强等人在2020年的一篇专题研究中写道,三阴性乳腺癌常伴有更大的肿瘤体积、更差的组织学分级、更多的淋巴结受累等特征。“年轻遇见三阴性乳腺癌,往往加剧肿瘤侵袭性、肿瘤异质性、治疗反应不佳、治疗手段有限等特质,表现为更差的远期预后。”
随着治疗手段的发展,过去10多年,在晚期乳腺癌中,人类表皮因子生长受体2(HER-2)阳性乳腺癌患者总生存情况不断改善,但三阴性乳腺癌等患者的生存改善并不明显。
这和三阴性乳腺癌缺少“治疗靶点”有关。通常情况下,针对雌激素受体、孕激素受体表达阳性的乳腺癌患者,可采用调节激素内分泌治疗方式;针对HER-2阳性的,可采用抗HER-2的靶向治疗。
三阴性乳腺癌就是指雌激素受体、孕激素受体、HER-2均为阴性。“这3个指标都是阴性,意味着内分泌和靶向治疗等相关方法不太适用。”韩宝三告诉“医学界”,在手术的核心治疗基础上,联合化疗是三阴性乳腺癌的主要治疗手段。但随着临床研究不断深入,新辅助治疗、免疫治疗等运用逐渐崛起,三阴性乳腺癌有了更多的治疗选择。
2020年,Journal of Clinical Oncology发表复旦大学附属肿瘤医院团队研究证实,在传统术后辅助化疗方案中加一个化疗药物,能将三阴性乳腺癌患者的5年无病生存率提升至86.5%,高于标准辅助化疗方案的80.3%。这被称为三阴性乳腺癌治疗的“中国方案”。
还有研究支持,在这类患者的新辅助治疗中,对于有PD-L1表达者,可采用化疗联合免疫治疗,能提高病理学完全缓解率。
对于已经尝试过至少2种药物治疗的晚期患者,抗体偶联药物也可能是一种选择。而化疗+靶向治疗+免疫治疗的三联方案在部分晚期患者中,展现出优异疗效与可控的安全性。
更大的突破体现在临床诊断中。2019年,“复旦分型”问世,它基于病理诊断、基因检测报告等,将三阴性乳腺癌分为4个不同亚型,为精准治疗提供了理论依据。
5年后,《柳叶刀-肿瘤学》发表FUTURE-SUPER研究称,基于“复旦分型”的精确治疗可显著延长晚期三阴性乳腺癌一线治疗的无进展生存期,且毒性可控。在该研究设计中,4个不同亚型的患者获得了完全不同的治疗方案。
“目前,还有一些预防三阴性乳腺癌复发的疫苗正在做临床试验,相信在未来会有较好的消息公布。”庄时利和表示,总体上,乳腺癌是预后相对比较好的肿瘤,在中国、日本和美国,乳腺癌生存率都高于很多常见肿瘤。
关键还是“早发现”
根据《2022年全国癌症报告》,在女性群体中,乳腺癌是发病数第二高的恶性肿瘤,每年新发病例数达35.72万例,三阴性乳腺癌占比约15%-20%。
今年5月,中国工程院院士、国家肿瘤质控中心乳腺癌专家委员会主任委员徐兵河接受《中国科学报》采访称,近10年,我国乳腺癌发病率呈现5个特点,包括发病人数呈上升趋势,发病年龄年轻化,中晚期乳腺癌比例高,预后不佳的乳腺癌类型比例高,以及地区差异明显。
在论及“为何中国早期乳腺癌患者的确诊比例低于发达国家”时,徐兵河认为,主要原因就是筛查不充分。
《中国女性乳腺癌筛查指南(2022年版)》提出,一般女性从40岁开始筛查乳腺癌。对于有乳腺癌家族史的高危女性,开始筛查年龄要比家庭中确诊为乳腺癌时年龄最小者小10岁,但应≥25岁。
针对我国三阴性乳腺癌临床病理特征与预后的Meta分析显示,对<35岁、有乳腺癌家族史的人群开展乳腺癌筛查,同时检查乳腺癌易感基因BRCA1表达状态,或许有利于三阴性乳腺癌的早发现、早诊断、早治疗,改善临床预后。
但根据徐兵河在采访中介绍的数据,2015年我国只有18.9%的成年女性接受乳腺癌筛查。2018年到2019年,35-64岁女性的乳腺癌筛查覆盖率是30.9%。
除了年龄,筛查手段也可能影响结果。
国际指南推荐的乳腺癌最主要筛查手段是钼靶。西方女性的乳房组织相对疏松,钼靶穿透性较好,较易发现里面的结节。中国女性乳腺癌的中位发病年龄为47岁,此时的乳房组织呈致密性,钼靶穿透性比较差,不易发现小的肿块。徐兵河称,仅以钼靶筛查为准,可能导致30%的病人漏诊。
徐兵河团队研究提出,对不同年龄的女性应采用不同的组合筛查方式。对于45岁以下的女性,乳房组织相对致密,筛查方式以超声为主、钼靶为辅;对于45岁以上者,乳房组织相对疏松,筛查方式以钼靶为主、超声为辅。
此外,乳腺MR成像(MRI)可作为乳腺超声、X线检查之外重要的补充检查方法,还可用于基因突变携带者等高危人群筛查。
参考文献:
1。中国临床肿瘤学会乳腺癌专家委员会,等。 中国年轻乳腺癌诊疗专家共识(2022)。 中华医学杂志。 DOI:10.3760/cma.j.cn112137-20220907-01895
2。中国抗癌协会乳腺癌专业委员会,等。中国晚期三阴性乳腺癌临床诊疗指南(2024版)。 中华肿瘤杂志。 DOI:10.3760/cma.j.cn112152-20240118-00034
3。曹希,等。 年龄与三阴性乳腺癌患者预后的关系。中国普通外科杂志。 doi:10.7659/j.issn.1005-6947.2020.05.001
4.Fan L, et al。 Optimising first-line subtyping-based therapy in triple-negative breast cancer (FUTURE-SUPER): a multi-cohort, randomised, phase 2 trial。 The Lancet Oncol。 doi: 10.1016/S1470-2045(23)00579-X
5。李林容,等。 三阴性乳腺癌临床治疗进展。 协和医学杂志 。 DOI:10.12290/xhyxzz.2022-0085
6。中国工程院院士徐兵河:早筛可提高乳腺癌患者生存率。 中国科学报
7。中国研究型医院学会乳腺专业委员会中国女性乳腺癌筛查指南制定专家组。 中国女性乳腺癌筛查指南(2022年版)。 中国研究型医院。 DOI:10.19450/j.cnki.jcrh.2022.02.003
来源:医学界















