调查表明违规生产是欣弗事件主因(图) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| http://www.sina.com.cn 2006年08月15日14:30 北京晚报 | |||||||||||||
|
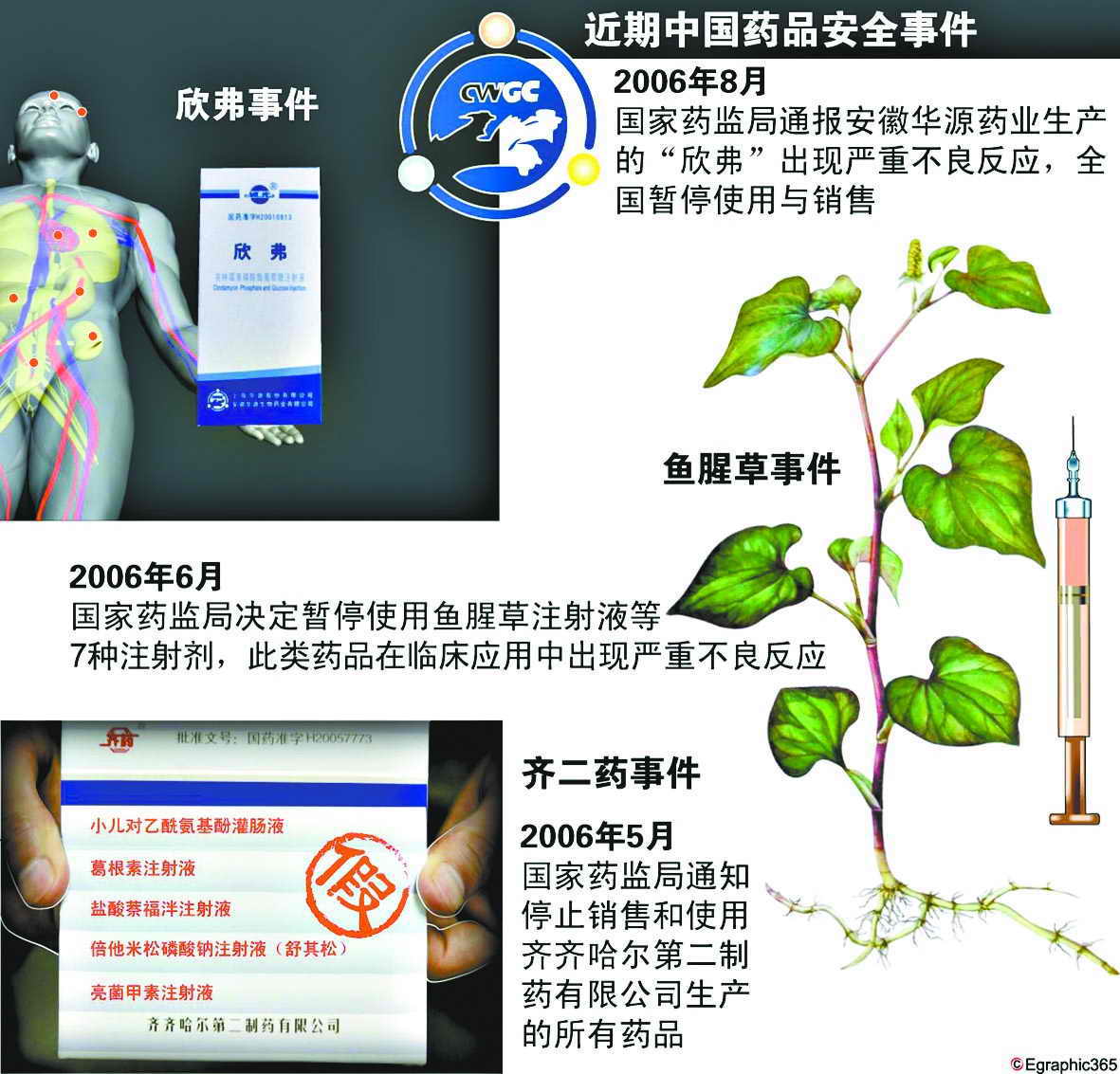
国家食品药品监督管理局今天上午通报了对安徽华源生物药业有限公司生产的克林霉素磷酸酯葡萄糖注射液(欣弗)引发的药品不良事件调查结果:现已查明,安徽华源生物药业
主要原因。 最新进展 药厂未按批准工艺灭菌 国家食品药品监督管理局会同安徽省食品药品监督管理局对安徽华源生物药业有限公司进行了现场检查。经查,该公司2006年6月至7月生产的克林霉素磷酸酯葡萄糖注射液未按批准的工艺参数灭菌,降低灭菌温度,缩短灭菌时间,增加灭菌柜装载量,影响了灭菌效果。经中国药品生物制品检定所对相关样品进行检验,结果表明,无菌检查和热原检查不符合规定。 欣弗清查尚未结束 这次不良事件发生后,药监部门开展了全国范围拉网式检查,尽全力查控和收回所涉药品。经查,安徽华源生物药业有限公司自2006年6月份以来共生产该产品3701120瓶,售出3186192瓶,流向全国26个省份。除未售出的484700瓶已被封存外,截至8月14日13时,企业已收回1247574瓶,收回途中173007瓶,异地查封403170瓶。 据介绍,国家食品药品监督管理局责成安徽省食品药品监督管理局对安徽华源生物药业有限公司的违法违规行为依法作出处理,并追究相关责任人的责任。各级药品监管部门将进一步配合卫生部门积极做好患者的救治工作。 药监局再发安全警示 为切实保障公众用药安全,国家食品药品监督管理局再次发出安全警示,强调药品生产企业必须建立健全质量保证体系,必须保证每个环节按照标准操作规程执行,必须对原辅料的购入、检验、使用等严格管理,必须严格按照法定标准、批准工艺组织生产,必须建立真实的药品生产记录和销售记录,必须保证产品检验合格后审核放行,确保药品生产质量。 服务 药品不良反应怎样应对 有些药物不良反应(ADR)是很难避免的,但有些是完全可以避免的。如果我们在用药时能注意下述几点,就可以预防或减少不良反应的发生。 第一,医师、药师和患者都应了解所用药物的基本药理以及患者的过敏史或药物不良反应史。第二,老年人、新生儿、孕妇和肝病、肾病患者等特殊人群用药要特别谨慎。第三,用药品种应合理。医师在用药时应避免不必要的联合用药,以免药物相互间发生不良反应;应用新药时,必须慎重用药,严密观察;应用对器官功能有损害的药物时,应按规定检查患者的器官功能。第四,在用药过程中,医师和患者都应注意药物不良反应的早期症状,以便及时停药和处理,防止不良反应进一步发展。 链接 我国药品召回目前尚属空白 我国政府从法规完善到监测实施,做了大量有成效的工作。1998年我国成为世界卫生组织国际药品监测合作计划的成员,并正式成立了国家药品不良反应监测中心。自2001年11月开始,国家食品药品监管局不定期向社会公开颁布《药品不良反应信息通报》。2004年3月15日卫生部和国家食品药品监督管理局联合发布了《药品不良反应报告和监测管理办法》,并建立了药品不良反应监测信息网络系统;这些对公众的合理用药、保障用药安全起到了警示和指导的作用。 然而由于受到经济、社会发展水平的制约,我国药品不良反应报告的现状同先进国家相比还有较大差距。世界卫生组织要求,药品不良反应监测体系健全国家,每年收到的病例报告数量不应该低于300份/百万人口。美国2002年收到的病例报告数量为320860份,合800份/百万人口。我国2003年全年的病例报告数量为36852份,合28份/百万人口。许多国家通过立法实施药品召回制度,有效地降低了药品不良反应造成的危害。2002年美国召回药品437种,其中非处方药达83种。我国目前已实施了食品召回,但对药品的召回目前尚属空白。 回顾 “欣弗事件”全程回放 2003年12月:国家药品不良反应监测中心提示克林霉素注射液可引起严重不良反应。 2006年7月27日晚:国家药监局接到青海省食品药品监督管理局报告。三个专家组于7月28日分赴青海省、安徽省协助进行事件调查工作,对涉及药品品种采取有效控制措施。 7月28日:安徽省食品药品监督管理局接到情况通报后,组织人员随国家食品药品监督管理局派出的调查组一起进驻安徽华源公司进行调查,封存了有关原料、辅料和药品。 8月2日:按照国家食品药品监督管理局的要求连夜向全国其他省、自治区、直辖市食品药品监督管理部门发出了紧急协查函,暂停销售和使用该品种。对已售出的药品,责成企业立即收回。 8月3日:卫生部连夜发出紧急通知,停用上海华源股份有限公司安徽华源生物药业有限公司生产的药品欣弗。通知说,青海、广西、浙江、黑龙江和山东等省、自治区陆续出现部分患者使用上海华源股份有限公司安徽华源生物药业有限公司生产的克林霉素磷酸酯葡萄糖注射液(又称欣弗)后,出现胸闷、心悸、心慌、寒战、肾区疼痛、腹痛、腹泻、恶心、呕吐、过敏性休克、肝肾功能损害等临床症状。国家药监局要求安徽省食品药品监督管理局采取进一步的措施,控制涉及药品不在临床继续使用。将有关情况通报卫生部,提请医疗机构注意;同时向媒体通报。 8月4日:要求各级食品药品监督管理部门立即对安徽华源公司生产的克林霉素磷酸酯葡萄糖注射液停止使用。 8月10日:国家食品药品监督管理局召开新闻发布会,通报了对安徽华源生物药业有限公司生产的克林霉素磷酸酯葡萄糖注射液(欣弗)引发的药品不良反应事件调查进展:初步分析认定,企业未按批准的生产工艺进行生产,生产记录不完整,这有可能是导致药品集中出现不良反应事件的原因。J146 相关专题:卫生部通知停用药品欣弗 |
| 新浪首页 > 新闻中心 > 国内新闻 > 卫生部通知停用药品欣弗专题 > 正文 |
| |||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||