|
|
|
|
佰易药品销售量大于生产量http://www.sina.com.cn
2007年02月04日17:29 CCTV《经济半小时》
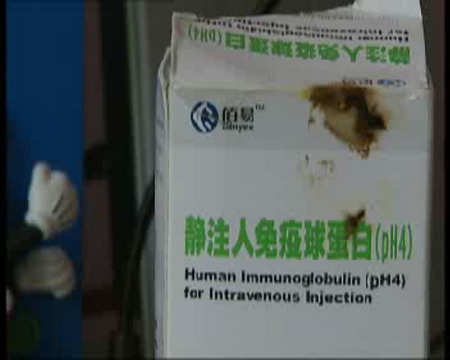 广东佰易药业在生产静注人免疫球蛋白过程中,存在违规行为,已被叫停 销售量竟然大于生产量? 学生小婷在北京注射了广州佰易药业生产的“静脉注射用人免疫球蛋白”后,检测出丙肝病毒抗体呈阳性,幸运的是,她的RNA化验结果还是呈阴性,也就是说她并没有染上丙肝,北京市卫生局随后发现,另外还有40多位受害者,症状和小婷一样,虽然,这次的问题药没有酿成悲剧,但是回想起来还是让人提心吊胆,丙肝抗体怎么会进到药里面呢?为了进一步了解真相,记者到广东佰易药业有限公司进行了调查。 记者:“据了解,广州佰易药业有限公司的新厂区,是在2006年5月开始逐步搬迁过来的,并且在2006年11月24日获得了国家的GMP认证,但现在这个厂已经空无一人,所有的生产全部停止了下来,前不久,国家有关部门取消了他们的GMP证书。” 目前卫生部、国家食品药品监督管理局等部门,已经组成调查组,对广东佰易药业有限公司展开现场调查,调查组发现,广州佰易的这批药销售量大于生产量。 韶关市食品药品监督管理局稽查分局局长简冰浩:“从我们第一天检查的情况来看,这个批次我们取得了有效证据,就已经超过几百瓶。” 销售量大于生产量,这显然是一个不合逻辑的现象,这里到底隐藏着什么不为人知的秘密呢?通过分析,调查组最终认定,厂家采用的是套用批号的方式。 广东省食品药品监督管理局稽查分局局长方洪天:“打个比喻,某个批号的产品,它的生产记录是四千支,但是它套用批号,套用这个产品的记号,有可能8千支。” 在采访中记者了解到,套用批号,并不是简单的书面造假,对于药品这种特殊的商品来说,套用批号,可能带来的直接后果就是药品的安全隐患。 简冰浩:“ 这个批记录,也是各个生产环节的一个记录,套用这个批号了,这个药品的各个环节,没有一个原始的记录在这里,我们就无从确认整个过程的安全性、合法性,无从认定最后的成品,是否安全、是否合格。” 而记者了解到,广州佰易要之所以要套用批号,与2006年新厂区的搬迁有密切关系,因为佰易药业有限公司从旧厂停止生产到11月份重新获得GMP证书的这段时间内,根据国家药检局的规定,是不能生产和销售该厂的产品,而对于这个规定,厂家显然是心知肚明,2006年7月4号,该厂还专门给韶关市食品药品监督管理局写下了一份承诺书。 简冰浩:“ 他也向我们局郑重承诺,在新厂址生产的产品,在未通过GMP认证和获得GMP证书之前,不进入市场销售,他也是向我们承诺了,但他还故意造假。” 厂家为了追回停产搬迁半年损失的利润,竟然不惜铤而走险,套用批号,违规生产,这给问题药的生产埋下了安全隐患,但追根溯源,问题药中的丙肝抗体,并不是生产环节出现的,而应该出现在采集的血浆原料上,那么,广东佰易药业采血浆的渠道又是什么运转的呢?记者又顺藤摸瓜,赶到了广东连山,对佰易药业设在当地的单采血浆站进行了调查。 在广东省连山壮族瑶族自治县的一座废弃的人民医院里,记者找到了连山单采血浆站。 记者:“广东佰易药业有一个原料采集点,连山单采血浆站,我们来到这里的时候,这个大门紧紧的关着,而在大门的旁边我们看到了这样一个通知,从2007年的元月22日开始,这个采浆站停止采浆。” 记者试探地拉动铁门,没想到铁门没有锁死,在值班室里,记者发现了一个留守的工作人员。 记者:“现在只有你一个人了吗?” 连山丹采血浆站工作人员:“是啊。” 记者:“其他人呢?” 工作人员:“其他人放假回家了。” 记者:“什么时候放假的?” 工作人员:“就是从22号开始的。” 据了解,连山单采血浆站的前身是连山县人民医院的血站,2004年在全国整治非法采集血浆的活动和单采血浆的专项整治工作中因存在降低跨区采浆、频采、超采等违规行为被关停,2005年8月由广州佰易公司收购后重新开始采浆,成为广东省第一个改制的单采血浆站,目前已向佰易公司提供18.8吨血浆,然而记者在连山卫生局了解到,这个血浆站改制才半年多时间,也就在2006年的6月遭到了卫生行政部门的处罚。 连山县卫生局副局长冀世惠:“有群众举报说那个里面有冒名顶替的,频采多采这方面的问题,我们卫生局就协同卫生监督所一起去检查,就发现确实存在这个问题。” 记者:“像这种频采或者多次采血的话,是不是会对血浆存在安全隐患?” 冀世惠:“如果存在这个问题,对这个肯定存在一定的隐患。”
【发表评论】
|
不支持Flash
|