近日,中国、美国、德国及法国等多国学者携手,找到了导致先天性小头畸形合并先天性肾病综合征的新的致病基因。该研究解析了影响肾脏和颅脑神经发育早期的KEOPS复合体相关基因及其致病机制,为深入研究神经细胞和肾脏细胞在基本生理功能开辟了新的视野。
复旦大学附属儿科医院肾脏科副主任医师饶佳表示,该研究对先天性肾病和先天性小头畸形的患儿致病基因的诊断,及寻找新的治疗靶点提供科学依据,同时,在端粒酶的功能研究中,有望对延长人的寿命药物研发提供新的靶点。
近日,饶佳医师与分别来自美国、法国的研究者作为共同第一作者,在最新一期《自然》子刊Nature Genetics上发表了这一重要成果。
随着基因诊断技术的日新月异,发现并证实了越来越多的单基因致病的先天性神经发育障碍和先天性肾病,为出生缺陷的早期筛查和新的诊疗方向提供了科学依据。目前已明确的12种先天性小头畸形的致病基因,30多种单基因致病的先天性肾病综合征基因。Galloway-Mowat综合征是一种常染色体隐性遗传的罕见病,以先天性肾病和小头畸形为突出特征,罹患此种疾病的婴儿在出生早期往往表现为头部异常小,生后逐渐出现癫痫发作或智力障碍,同时出现蛋白尿并进展为肾功能衰竭。先天性肾病和小头畸形作为严重的出生缺陷,目前缺乏有效的产前诊断检测指标,救治难度高,即便在发达国家地区死亡率也相对较高。

饶佳医师在复旦大学儿科医院人才培养计划的基金资助下,于2014前往美国哈佛医学院波士顿儿童医院进行博士后研究工作。在全美著名的肾脏病分子遗传学专家Friedhelm教授指导下,主要从事儿童肾脏疾病致病基因的发现和分子机理研究,先后在儿童肾病综合征遗传分子诊断策略的优化,发现证实新的致病基因领域参与发表了多篇学术论著。
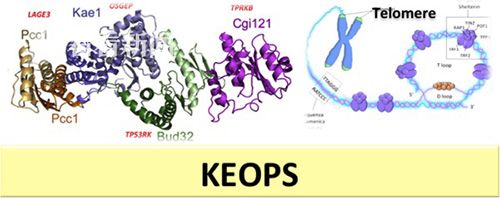
饶佳解释说,2015年南美洲爆发寨卡病毒导致数千名婴儿一出生即小头畸形,在这一公共卫生事件的大背景下,波士顿儿童医院的Friedhelm教授团队通过募集了全球100多个医疗中心800多名先天性肾病合并神经系统发育障碍(包括小头畸形)的家系进行了全外显子测序。饶佳首先在来自亚洲伊朗、中国香港、台湾及日本的15个病人中发现了KEOPS复合体相关基因的突变,提出了KEOPS复合体这一古老的细胞核元素同时影响了神经细胞和肾脏细胞发育的设想。
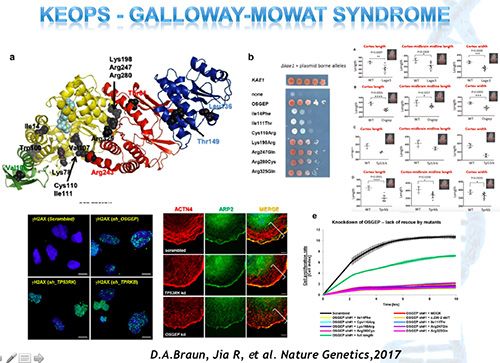
在之后的两年里,来自不同国家的研究团队联手,分别从KEOPS复合体的分子结构、神经细胞和肾脏细胞中DNA损伤修复及端粒酶调控、CRISP/Cas9介导的基因编辑术下斑马鱼及小鼠模型等方面,深入的解析KEOPS复合体相关基因突变导致肾脏和颅脑神经发育障碍的致病机制。在不久的将来,全球的研究专家希望籍此进一步研发对先天性神经和肾脏发育缺陷的靶向治疗,甚至通过端粒调控的研究深入发掘有助于延缓人类寿命的“青春不老药”。

本项目启动了复旦大学附属儿科医院与哈佛大学波士顿儿童医院两院肾脏科,Friedhelm教授和徐虹教授的两个团队的共建合作,将在肾脏疾病基因和分子机制研究领域的开启“共建双一流”的新纪元。
(看看新闻Knews记者:霍云 通讯员:罗燕倩 实习编辑:蔡悦扬)
版权声明:本文系看看新闻Knews独家稿件,未经授权,不得转载。









