清华新闻网12月26日电 12月23日,清华大学生命科学学院王新泉教授与医学院向烨研究员合作在《细胞研究》(Cell Research)期刊在线发表题为《SARS冠状病毒刺突糖蛋白冷冻电镜结构揭示其受体结合的必需构象状态》(Cryo-electron microscopy structures of the SARS-CoV spike glycoprotein reveal a prerequisite conformational state for receptor binding)的研究论文,首次解析了高致病性冠状病毒SARS-CoV表面刺突蛋白(spike)蛋白的近原子分辨率结构,并捕捉到刺突蛋白的多种中间构象,揭示了SARS冠状病毒入侵宿主细胞过程中必需的动态结构变化。
高致病性冠状病毒感染是全球公共卫生的重大威胁。2002-2003年严重急性呼吸道综合征冠状病毒(SARS-CoV)的爆发导致全球8000多人感染,800多人死亡;2012年中东呼吸系统综合征冠状病毒(MERS-CoV)从中东地区开始流行,已导致1800多人感染,600多人死亡。2015年世界卫生组织列出了8种可能引起严重爆发性流行的危险病原体,SARS冠状病毒和中东呼吸系统综合征冠状病毒名列其中。迄今为止,还没有针对这两种冠状病毒的特异性药物和疫苗。
冠状病毒刺突蛋白(spike)为同源三聚体,位于病毒囊膜表面,是已知最大的病毒表面蛋白。刺突蛋白在病毒与宿主细胞接触,与宿主细胞受体结合以及病毒-宿主细胞膜融合过程中起着关键作用,同时也是中和抗体结合及疫苗研发的重要靶点。
冠状病毒刺突蛋白从非激活态到激活态的构象变化。
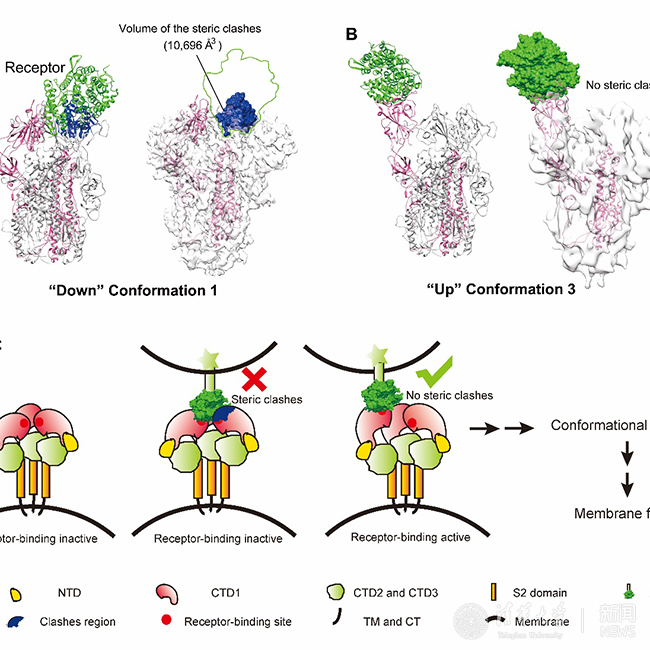
本研究通过冷冻电镜单颗粒三维重构的方法解析了SARS冠状病毒刺突蛋白四种构象的结构。其中构象一为三重对称的结构,分辨率达4.3 埃,在此构象下刺突蛋白的三个受体结合区(RBD)都处于“向下”位置,由于空间位阻,SARS冠状病毒细胞受体血管紧张素转化酶2(ACE2)无法结合刺突蛋白,因此该构象为受体结合的非激活状态。其余三种构象刺突蛋白的对称性被破坏,一个受体结合区抬起处于“向上”位置,在该构象下细胞受体能顺利结合抬起的受体结合区而没有空间位阻,因此这三种构象为受体结合的激活状态。受体结合区从“向下”位置到“向上”位置的转换也是中和性抗体与spike的结合所必需,并且可推广到中东呼吸系统综合征冠状病毒等其他类似的冠状病毒,这对理解冠状病毒侵染宿主细胞的分子机制,以及特异性药物和疫苗的开发提供了重要指导。
王新泉教授和向烨研究员均为北京结构生物学高精尖创新中心及清华大学医学院传染病研究中心成员,长期从事病毒侵染及免疫逃逸相关的结构生物学研究。2013、2014和2015年,王新泉教授和张林琦教授团队在《细胞研究》(Cell Research)、《科学-转化医学》(Science Translational Medicine)和《科学报告》(Scientific Reports)上分别报道了中东呼吸系统综合征冠状病毒表面刺突蛋白的受体结合区受体结合区与人受体二肽基肽酶4(DPP4)复合物的晶体结构,靶向受体结合区的中东呼吸系统综合征冠状病毒人源中和性抗体MERS-4和MERS-27的筛选与鉴定,以及MERS-27发挥中和作用的分子机制。2016年2月,向烨研究员团队与合作者在《科学》(Science)期刊上报道了埃博拉病毒表面糖蛋白GP与高效中和抗体的冷冻电镜结构和中和机制;6月,向烨研究员团队又独立在《自然》(Nature)期刊上报道了噬菌体突破细菌细胞膜的新机制。此次,两研究组共同协作,解析了SARS冠状病毒刺突蛋白的冷冻电镜结构,并捕捉到了病毒侵染过程中关键的中间状态,极大地促进了研究界对病毒侵染机制的理解。
清华大学医学院向烨研究组联合培养博士生桂淼和生命学院2014级博士生宋文飞为本论文的共同第一作者,王新泉教授和向烨研究员为本论文的共同通讯作者。
王新泉教授实验室博士生周海霞,向烨研究员实验室博士生许靖蔚和陈思炼参与了本项工作。该工作的冷冻电镜数据采集在国家蛋白质科学设施(北京)的清华大学冷冻电镜平台完成,数据处理在国家蛋白质科学设施(北京)清华大学高性能计算平台完成。本工作获得国家自然科学基金委、科技部重点研发计划和北京市结构生物学高精尖创新中心等的经费支持。
论文链接:
http://www.nature.com/cr/journal/vaop/ncurrent/full/cr2016152a.html
供稿:生命学院 编辑:李华山









